近年来,太阳集团tyc5997罗海彬团队联合中山大学药学院李哲研究团队在基于自由能微扰的药物设计新方法取得系列重要进展,取得药物设计关键技术的突破,实现自由能微扰(FEP)/药物设计新方法的国产化和自主可控。近日,该团队提出了一种“基于组合结构的相对结合自由能 (CS-FEP)”药物设计新方法,用于高效精准地计算药物分子与生物大分子靶点间的结合自由能,为新药研发提供了强有力的计算工具,相关研究成果[1]发表在国际著名药学期刊Acta Pharm. Sin. B上。
当前人类健康领域面临若干的重大挑战,包括重大疾病(如恶性肿瘤、糖尿病、心血管疾病等)及突发的恶性传染病(如新冠肺炎、SARS、埃博拉等)。因此,亟需加快新药研发速度,以应对以上挑战,尤其是大规模突发疫情来袭之时,尽快获得应急药物以控制疫情的发展。如何精准预测药物与靶标的亲合力(结合自由能)以获得高亲合力的小分子药物,一直是计算机辅助药物设计领域的“圣杯”,若能精准预测药物/靶标亲合力,将能加速先导化合物药物的发现及优化效率,从而明显缩短新药创制周期及降低研发成本。美国药物设计顶级软件薛定谔发展的自由能微扰(FEP)/相对自由能预测方法受到制药和科研工作者的极大关注(JACS 2015,137,2695),然而该方法主要被应用于预测结构相似配体间的相对结合自由能,无法预测不同骨架的化合物与靶标的亲合力,且许可费用昂贵,限制了该方法的应用范围。
自由能微扰是一种基于统计力学理论严格推导而来的方法,具有较高的理论精度,在药物/靶标亲合力预测方面具有很好的应用前景。然而,该类方法对计算资源消耗极大,且缺乏公认的最佳流程,尚未得到广泛的应用。传统的基于自由能微扰理论的药物-靶点相对结合自由能计算方法(FEP-RBFE)虽然理论上严谨,但在模拟非物理中间态时往往遇到一系列收敛性问题,限制了其在药物设计实践中的应用。
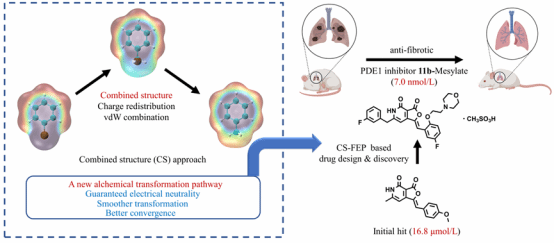
图1. CS-FEP原理示意图及CS-FEP导向的抗肺纤维化PDE1抑制剂结构优化
针对药物设计领域的重大难题,罗海彬/李哲团队创新性地提出了CS-FEP方法(图1)。该方法构建了全新的热力学微扰路径,显著提高了计算过程中相邻状态间的相空间重叠,从而大大加快了FEP计算收敛速度。研究人员利用CS-FEP方法指导了针对磷酸二酯酶-1(PDE1)抑制剂的结构优化。通过计算不同候选分子与PDE1靶点的相对结合自由能,研究人员成功地将一个苗头化合物(IC50=16.8 μM)优化为一个高活性先导化合物(IC50 = 7.0 nM),抑制活性提高了约2400倍。进一步的实验研究表明,该化合物在动物模型上具有显著的抗纤维化效果,有望成为治疗相关疾病的新型候选药物。该方法既可以明显提高药物/靶标亲合力的预测精度(理论亲合力与实验亲合力差值绝大多数小于2 kcal/mol),还可以提高预测速度(传统FEP方法每个化合物的预测时间为20-30天,本方法缩短为1天以内,效率提高30倍),从而提高创新药物发现的成功率并降低研发时间。
中山大学李哲副教授等为论文的第一作者。海南大学为本论文的共同通讯单位,中山大学吴一诺副教授、美国肯塔基大学湛昌国教授和海南大学罗海彬教授为本论文的共同通讯作者。论文全文链接为https://www.sciencedirect.com/science/article/pii/S2211383524002521。
近年来,罗海彬/李哲联合团队在基于自由能微扰理论的药物设计方法学研究中进行了一系列算法布局,致力于将FEP计算方法应用于药物设计的各个典型应用场景。早在2019年,他们开发了高斯函数增强的FEP(GA-FEP)算法,用于计算药物分子与靶点蛋白的绝对结合自由能(ABFE)。通过使用多个高斯分布拟合采样得到的势能差概率分布,该算法提高了FEP-ABFE计算方法的计算精度。他们进一步利用GA-FEP算法指导了针对PDE10的先导化合物优化,成功发现一个亚纳摩尔级别(IC50=0.87 nM)的高活性抑制剂[2],相关工作发表于J Med Chem上。
为了大幅度提高GA-FEP的预测速度,以提高药物设计效率,他们发展了基于“约束能量分布”(Restrained Energy Distribution, RED)函数的加速FEP-ABFE方法。2020年初新冠疫情暴发后,罗海彬/李哲团队迅速将FEP-ABFE方法应用于针对新冠病毒主蛋白酶的药物应急响应,对超180万个化合物的数据库(包括商业及已知药物数据库)进行了虚拟筛选,在2周内全球首次完成超过1.2万化合物的基于FEP绝对结合自由能的高精准预测,从而预测出25个对新冠肺炎主蛋白酶Mpro有较高亲合力的上市药物,从中发现了多种对新冠病毒主蛋白酶有抑制作用的药物分子。其中,抗病毒活性最强的药物双嘧达莫在后续的临床研究中显示了良好的治疗效果。相关研究成果[3-4]发表在当年Proc. Natl. Acad. Sci. U.S.A和Acta Pharm. Sin. B期刊上。相关工作也获得2021年超级计算应用领域最高奖项 “戈登贝尔”提名奖,为我国药学领域首次入围该奖项。
除了高精度预测/筛选外,该FEP-ABFE方法还可应用于其他新药设计工作中,如骨架跃迁和全新药物设计等,以提高先导化合物的发现和优化效率。该团队首次提出了将FEP-ABFE应用于指导苗头化合物的骨架跃迁。他们基于对经典PDE5抑制剂他达那非及其衍生物与PDE5结合模式的分析,研究人员采用FEP-ABFE方法指导设计了一系列新骨架化合物,最终获得具有新颖骨架优选化合物L12 (IC50 = 8.7 nM),这为治疗勃起功能障碍和肺动脉高压提供了全新的候选化合物[5]。这一成果发表在2022年的Acta Pharm. Sin. B期刊上。
2023年,该团队还在药物设计权威期刊J Chem. Inf. Model.上发表了两项FEP算法相关的研究成果[6-7]。第一项工作提出了基于图论的加权环闭合(wcc)算法,用于提高FEP-RBFE计算的精度。传统的环闭合误差校正方法假设每对分子间FEP-RBFE计算对总误差的贡献相同,但这在实际计算过程中往往不成立。wcc算法引入了基于图论的加权策略,可根据不同分子对FEP-RBFE计算的误差大小赋予不同的权重,从而更准确地校正了FEP-RBFE计算结果。另一项工作在原先RED函数的基础上进一步推导出"平衡位置的约束能量分布"(Restraint Energy Distribution at Equilibrium position,RED-E)函数,并基于RED-E函数开发了一套新的算法,用于自动优化和加速FEP-ABFE的计算。相比传统的FEP-ABFE计算方案,基于RED-E函数的新方法可将计算效率提高近6倍,并能更好地处理约束过程势能差概率分布的非高斯性,以及增加FEP-ABFE计算的收敛性。这两项工作对FEP方法在药物设计实践中大规模应用(如虚拟筛选、大规模的化合物优化等场景)具有重要意义。
总的来说,罗海彬/李哲联合研究团队在自由能微扰理论指导下的药物设计方法学研究已形成了独特的创新体系(包括相对自由能微扰方法CS-FEP[1]和绝对自由能微扰方法GA-FEP[2-6]),涵盖了从算法发展、虚拟筛选、骨架跃迁、结构优化到构效关系研究等药物发现的多个环节。尤其是此次提出的CS-FEP方法,有望成为加速先导化合物优化的"利器",为新药研发注入新的动力。未来,研究人员还将继续完善相关方法,增加基于FEP的药靶亲和力精准预测算法的计算效率和精度,为新药研发持续赋能。
参考文献:
1. Acta Pharm. Sin. B 2024, DOI: 10.1016/j.apsb.2024.06.021
2. J. Med. Chem. 2019, 62, 2099–2111.
3. Proc. Natl. Acad. Sci. U.S.A. 2020, 117(44): 27381-27387.
4. Acta Pharm. Sin. B 2020, 10:1205-1215.
5. Acta Pharm. Sin. B 2022, 12: 1351-1362
6. J Chem. Inf. Model. 2023, 63, 561-570.
7. J Chem. Inf. Model. 2023, 63, 7755-7767.
 联系地址:太阳集团tyc5997
联系地址:太阳集团tyc5997 联系电话/传真:0898-66254967
联系电话/传真:0898-66254967 E-mail:yxyyb@hainanu.edu.cn
E-mail:yxyyb@hainanu.edu.cn
